2021年《医疗器械监督管理条例》中明确了医疗器械从研发、生产以及上市后的监管责任,2022年12月发布《企业落实医疗器械质量安全主体责任监督管理规定》,强化医疗器械生产、经营企业质量安全关键岗位人员责任,企业责任主体明确到了研发、质量、生产、销售、售后环节具体负责人;GB9706.1-2020已于2023年5月1日的正式实施,ISO13485:2016标准同年升级为国家标准GB/T42061-2022,国家器审中心陆续发布近700多项产品技术审查指导原则,对医疗器械注册中涉及到的各部门人员提出了更高要求,特别是研发、技术、注册与质量人员,医疗器械注册人制度试点工作的全面铺开,进一步刺激了医疗器械创新研发市场。
经过3年的后疫情时代,国家对医疗器械法规与制度的健全与监管加严,为帮助各企业更充分理解、执行法规标准的要求,比如:人工智能的广泛应用,课程内容将具体的产品注册融入到研发全过程中,解决企业注册申报文件问题,结合《医疗器械监督管理条例》,特举办本培训班,该课程继续以实务为主题,把产品研发、注册与《医疗器械生产质量管理规范》及风险管理GB/T420622-2022、质量管理体系GB/T42061-2022充分结合,从而加深学员对法规的理解,提高产品研发、注册和体系考核相关文件写作能力,提升企业产品注册申报质量和效率。现将有关事项通知如下:
现将有关事项通知如下:
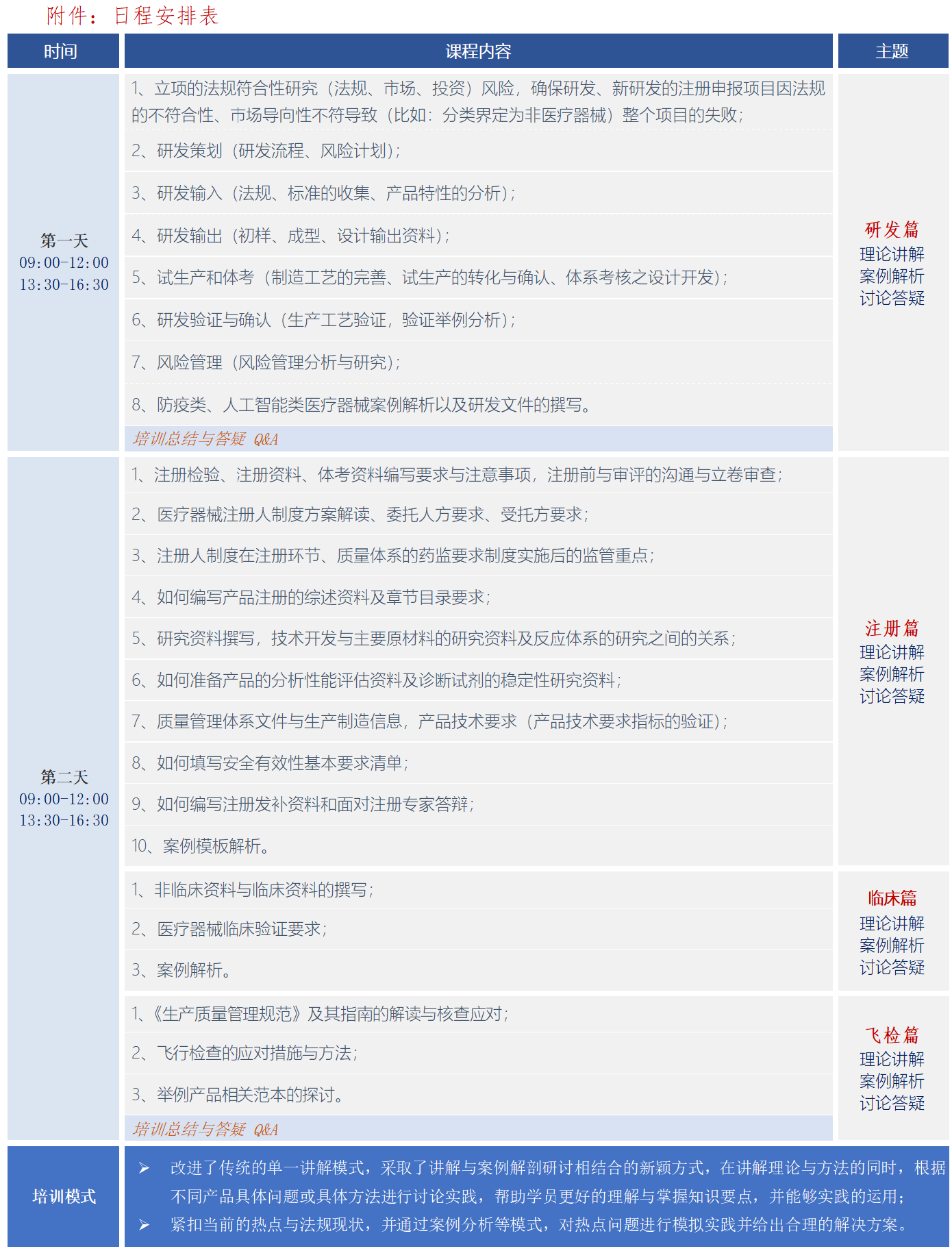
培训内容
培训特色
1、加深学员对医疗器械行业发展动向的理解和对医疗器械项目的策划;
2、提高产品研发、注册和体系考核相关文件写作能力;
3、提升企业医疗器械设计开发和质量体系的合规水平;
4、提升企业产品注册申报质量和效率。
授课讲师
北京中工医药研究院医疗器械特聘讲师,从业工作近20余年,有丰富的医疗器械项目策划、产品研发与申报注册经验,讲授本课程80余期。本课程根据相关实际案例进行讲解,实际工作参考适用性强。课程采取理论讲解、分组合作、案例实践与现场答疑相结合的模式授课,对医械企业培养自己优秀的新产品研发、注册申报工作人员有较大的帮助。
培训对象
Ⅱ、Ⅲ类医疗器械产品研发机构、科研人员、医疗器械生产企业负责人、管理者代表、法规部、注册部、质量部、研发部、工艺、测试等技术部部门相关人员。



 首页
首页




