2021年3月新修订的《医疗器械监督管理条例》正式公布,已于6月1日正式实施;新条例明确了医疗器械从研发、生产以及上市后的监管责任,通过加大处罚力度和监管力度推动企业加强自律,明确了企业落实医疗器械安全主体责任监督管理规定;企业责任主体明确到了研发、质量、生产、销售、售后环节具体负责人;随着医疗器械产品注册项目立卷审查要求的提出,注册申报前与监管机构的联系情况和沟通记录的要求;以及 GB9706.1-2020今年5月1日的正式实施,ISO13485:2016标准升级为国家标准GB/T42061-2022的陆续实施,500多项产品技术审查指导原则的陆续发布,对应一系列法规标准的变化,对医疗器械注册中涉及到的各部门人员提出了更高要求,特别是研发、技术、注册与质量人员,医疗器械注册人制度试点工作的全面铺开,进一步刺激了医疗器械创新研发市场。
经过3年的后疫情时代,经济的整体下行,国家对医疗器械法规与制度的健全与监管加严,医疗器械企业因疫情的冲击催生新的变革和行业洗牌。为帮助各企业更充分理解、执行法规标准的要求,比如:人工智能的广泛应用,课程内容将具体的产品注册融入到研发全过程中,解决企业注册申报文件问题,结合《医疗器械监督管理条例》,特举办本培训班,该课程继续以实务为主题,把产品研发、注册与《医疗器械生产质量管理规范》及风险管理GB/T42062-2022、质量管理GB/T42061-2022充分结合,以加深学员对法规的理解,提高产品研发、注册和体系考核相关文件写作能力,提升企业产品注册申报质量和效率。
现将有关事项通知如下:
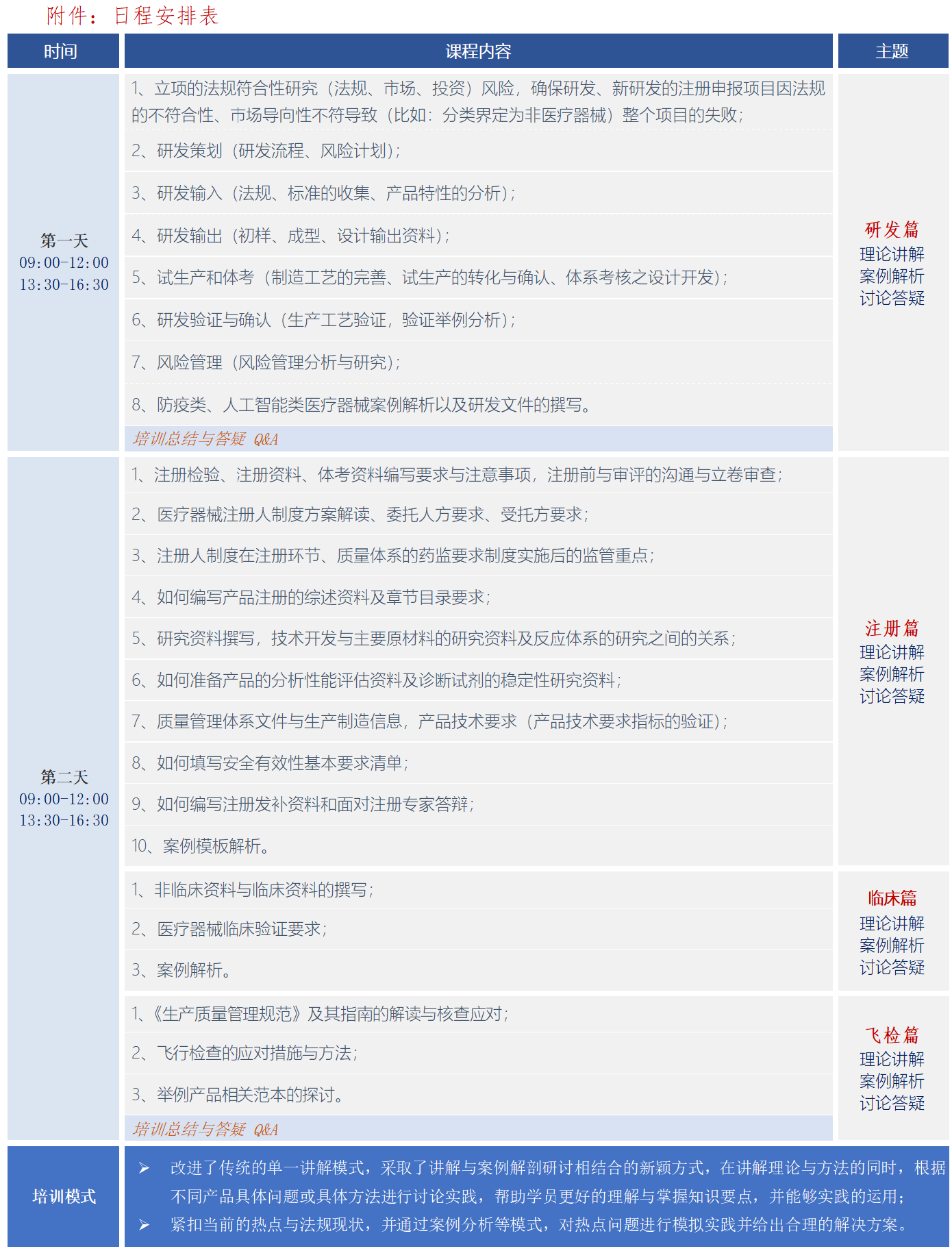
培训内容
培训特色
1、加深学员对医疗器械行业发展动向的理解和对医疗器械项目的策划;
2、提高产品研发、注册和体系考核相关文件写作能力;
3、提升企业医疗器械设计开发和质量体系的合规水平;
4、提升企业产品注册申报质量和效率。
授课讲师
北京中工医药研究院医疗器械特聘讲师,从业工作近20余年,有丰富的医疗器械项目策划、产品研发与申报注册经验,讲授本课程80余期。本课程根据相关实际案例进行讲解,实际工作参考适用性强。课程采取理论讲解、分组合作、案例实践与现场答疑相结合的模式授课,对医械企业培养自己优秀的新产品研发、注册申报工作人员有较大的帮助。
培训对象
Ⅱ、Ⅲ类医疗器械产品研发机构、科研人员、医疗器械生产企业负责人、管理者代表、法规部、注册部、质量部、研发部、工艺、测试等技术部部门相关人员。



 首页
首页




